9月28日��,鹽野義(Shionogi)宣布3CL蛋白抑制劑Ensitrelvir Fumaric Acid (S-217622)在亞洲進行的II/III期臨床試驗的III期部分達到主要終點�����。結(jié)果表明�,與安慰劑相比,ensitrelvir首次證明能夠顯著縮短奧密克戎(Omicron)五種典型癥狀的緩解時間。同時����,ensitrelvir在第4天(第三次給藥后)也顯示出病毒RNA載量的顯著減少���。
憑借在奧密克戎大流行階段進行的這項研究的結(jié)果����,ensitrelvir成為第一個在癥狀緩解時間上與安慰劑相比具有統(tǒng)計學顯著效果的研究性口服抗病毒藥物�。Ensitrelvir是北海道大學和鹽野義聯(lián)合開發(fā)的一款口服3CL蛋白酶抑制劑�,其作用機制與輝瑞獲得批準的COVID-19藥物Paxlovid相同��。SARS-COV-2具有3CL蛋白酶這種病毒增殖所必需的酶���,ensitrelvir通過選擇性地抑制3CL蛋白酶���,從而達到抑制SARS-COV-2增殖的效果。
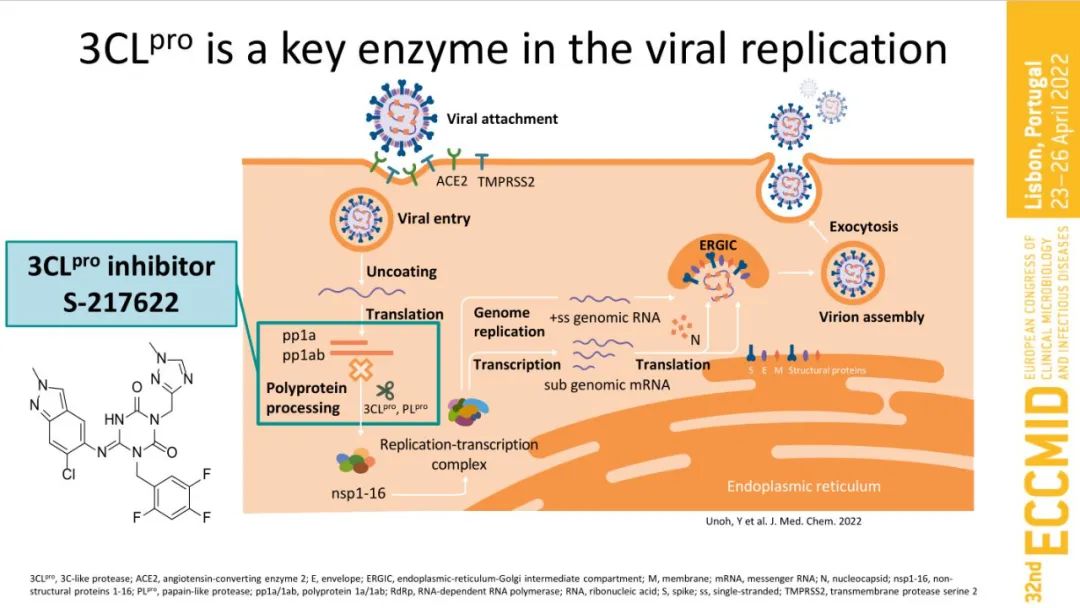
該研究在日本�、韓國和越南共招募了1821名COVID-19輕度/中度癥狀的患者,主要評價每天口服一次ensitrelvir(2個劑量組:高劑量和低劑量)相較于安慰劑,持續(xù)5天評估的臨床癥狀緩解效果��。該研究的主要終點是在癥狀出現(xiàn)后72小時內(nèi)隨機分配的患者中���,首次緩解SARS-CoV-2 Omicron 變體感染的五個關(guān)鍵COVID-19癥狀(鼻塞或流鼻涕�����、喉嚨痛�、咳嗽��、發(fā)熱或發(fā)燒���、精力不足或疲倦)時間,無論COVID-19 進展的風險因素如何(大多數(shù)患者已接種過疫苗)。評估的五種癥狀是在與醫(yī)療專家和監(jiān)管機構(gòu)協(xié)商后選擇的,包括日本厚生勞動省 (MHLW)�����、日本藥品和醫(yī)療器械局 (PMDA) 和美國食品藥品監(jiān)督管理局 (FDA)�。在該人群中�����,與安慰劑相比���,接受低劑量ensitrelvir(在日本提交批準的劑量水平)治療的患者首次緩解五種COVID-19癥狀的中位時間顯著縮短:167.9 vs 192.2 小時,24小時差異顯示統(tǒng)計學顯著性 (p=0.04)�����。鹽野義稱,在2022 年7月20日召開的藥事和食品衛(wèi)生委員會會議上審議了ensitrelvir的緊急批準��,并將根據(jù)III期研究的結(jié)果繼續(xù)審查,III期研究部分的關(guān)鍵結(jié)果已報告給MHLW和PMDA����。今年6月����,基于II期數(shù)據(jù)提交的ensitrelvir緊急授權(quán)申請被日本PMDA暫緩批準���,稱“需要進行更仔細的討論”����。當時的數(shù)據(jù)結(jié)果顯示����,ensitrelvir對傳染性SARS-CoV-2病毒同樣顯示出快速清除效果����,在治療的第四天(第三劑之后)���,病毒滴度陽性的患者比例與安慰劑相比減少了約 90%;與安慰劑相比��,ensitrelvir將傳染性病毒的脫落時間縮短了1-2 天。不過���,在癥狀改善上面,12種COVID-19癥狀的總分并沒有顯著差異,但事后分析顯示S-217622在5種“呼吸和發(fā)燒”癥狀的綜合評分有所改善��。7月4日����,鹽野義(Shionogi)及其與中國平安人壽保險股份有限公司的合資公司平安鹽野義共同宣布����,就新型冠狀病毒肺炎(COVID-19)口服抗病毒藥物3CL蛋白酶抑制劑ensitrelvir開始準備提交國內(nèi)新藥上市許可申請的相關(guān)資料��。并在7月14日�,發(fā)布了ensitrelvir針對奧密克戎BA.4和BA.5亞型變異株的體外抗病毒活性�。聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容�����,版權(quán)歸原作者所有��,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內(nèi)容���、版權(quán)和其它問題���,請與本網(wǎng)站留言聯(lián)系����,我們將在第一時間刪除內(nèi)容�!


